論文:ベンゾジアゼピン離脱における、ガバペンチン使用の補助効果に関するレトロスペクティブ研究
Leung, Edison MD, PhD; Ngo, Daniel H.; Espinoza, Joe A. Jr MD; Beal, Lauren L.; Chang, Catherine MD; Baris, Dalsu A. MD, PhD; Lackey, Blake N.; Lane, Scott D. PhD; Wu, Hanjing E. MD, PhD
Abstract
ベンゾジアゼピンからの離脱は、深刻で致命的なことになりかねない問題で、多くの患者がその離脱症状に苦しんでいる。現在、ベンゾジアゼピン離脱の治療に利用できる唯一の薬は、短時間作用型および長時間作用型のベンゾジアゼピンそのものである。(※ 訳注:ベンゾ離脱症状を抑え込む効果のある薬は(作用時間が)長短ふくめたベンゾジアゼピン薬だけであり、その薬自体のスローな漸減法しか離脱方法がない、という意味と思われる)。ベンゾジアゼピン離脱の治療に役立つ、別の処方薬を見出す必要がある。アルコール離脱の治療に適応外処方される、抗不安作用を持つガバペンチンは、ベンゾジアゼピン離脱症状を軽減する薬になる可能性がある。大規模な入院患者を抱える精神医療施設の電子カルテを使用して、ベンゾジアゼピン離脱症状を呈した 172人の患者を対象としたレトロスペクティブ研究(遡及的研究、後ろ向き研究)を実施した。その結果、他の疾患のため、たまたまガバペンチンを服用していた患者がベンゾジアゼピン離脱においてより良い結果をもたらした可能性があるようだ。この度の研究では、ガバペンチンが確かにその結果に関連しているのかどうかを調査分析した (N=57 ガバペンチン服用していた、N= 115 ガバペンチン服用していない)。
本レトロスペクティブ研究において、ガバペンチンを投与されていたベンゾジアゼピン離脱患者群は、ガバペンチンを投与されていなかった患者群と比較して、離脱中のベンゾジアゼピン総使用量は少量で済み、結果として入院期間は短期間であった。この結果は、ベンゾジアゼピン離脱を助けるために、補助薬としてガバペンチンの併用がうまくいく可能性を示している。ただし、この研究の限界として、サンプルサイズが小さいこと、サンプル全体の投薬管理戦略にばらつきがあること、は否めない。
ベンゾジアゼピンは、世界で最も広く処方されている薬物の 1 つであり、過去数十年にわたってベンゾジアゼピン身体依存と乱用が増加している1)。 3 ~ 6 週間という短期間の連用では、ベンゾジアゼピン使用者の15% ~ 44%が投薬をいきなり中止すると極度の不安と離脱症状を発症する2–4)。6ヶ月間以上の長期使用者になると、やはり急な投薬中止により服用者の約40%近くが中等度から重度の離脱症状を発症する1)。ベンゾジアゼピン依存症の形成は、腹側被蓋野におけるドーパミンの急増とグルタミン酸作動性受容体の発現変化によるものである5)(※ 訳注: グルタミン酸受容体の発現変化 ⇒ GluA2欠損AMPA 受容体の出現を誘導する。GluA2欠損AMPA受容体はCa2+(カルシウム)透過性が高く、ニューロン内が過興奮となる。参考:REFERENCE 5、および「ALSにおけるRNA編集異常と脊髄運動ニューロン死」)。ベンゾジアゼピンの突然の中止は、不安、パニック発作、震え、睡眠障害、視覚障害、発汗、不快感、知覚のゆがみ、発作、さらには死に至る生理学的および心理的な離脱症状を発生させる6)。現在まで、ベンゾジアゼピン離脱症状(とベンゾからの離脱)は伝統的にベンゾジアゼピンそのもののテーパリング(スローな漸減)によって対処されてきた7)。さらに言及するならば、ベンゾジアゼピンの使用は、上記で述べたように8)アディクション(精神依存)のリスクもあるし、過鎮静や呼吸抑制など好ましくない副作用の発生もあり得る9)。我々は、(ベンゾジアゼピンのテーパリングという手法だけでなく)ベンゾジアゼピン離脱治療に効果のある他の処方薬を発見し、特定する必要に迫られている。
ガバペンチンは、帯状疱疹後神経痛の治療 10) および難治性発作治療の補助剤として適応であるとFDA認可された処方薬である11)。さらに、ガバペンチンは神経障害性鎮痛薬として、特に糖尿病性神経障害の治療薬として広く使用されており12)、不安症の治療にも適応外処方されている13)。ガバペンチンは一般的に忍容性が高く、主な副作用は傾眠である14)。乱用される可能性も低く、連邦政府が指定する規制薬物ではない15)。不思議なことに、ガバペンチンはガンマアミノ酪酸類似体であるが、ガンマアミノ酪酸受容体(GABA受容体)にはあまり親和性がない。その代わり、ガバペンチンは中枢神経の電位依存性カルシウムチャネルに結合し、その抗侵害受容、抗けいれん、および抗不安特性を示している11,16)。(※ 訳注:ガバペンチンはニューロン内へのカルシウム(Ca2+)の流入とそれに続く興奮性神経伝達物質の放出を阻害する。REFERENCE11 より)。
とりわけガバペンチンはアルコール離脱症状とアルコールへの渇望を軽減することが実証されている17-19)。 アルコールとベンゾジアゼピンがその身体依存および耐性において同じ経路を共有しているメカニズムを考えれば20)、 ガバペンチンは、ベンゾジアゼピン離脱治療において補助薬として使用できる可能性があるのは理屈に合っており、有望であると考えられる。しかし、この可能性は正式に評価されたことはない。この研究の目的は、ガバペンチンがベンゾジアゼピン離脱治療、特に急性入院患者の治療において効果的な補助薬となるかどうかを判断することである。ガバペンチンの有効性を調査するにあたって、対象患者群の入院中に投与されたベンゾジアゼピンの総投与量、ベンゾジアゼピンが投与された回数、および入院期間(LOS, length of stay)が測定された。理論的にはガバペンチンはベンゾジアゼピンの投与量とLOSを減らすと言える。それにより、ベンゾジアゼピン離脱中の患者をより早く安定化させ、これにより病院での治療の経済的負担が軽減され、ベンゾジアゼピン離脱による合併症を減少させ、抗精神病薬の投与といった他の治療法・緩和策の使用を減らせる可能性がある。
METHODS
研究の設計とサンプル群
まず、研究を実施するために、テキサス大学健康科学センターのヒューストン・マクガバンメディカルスクールの治験審査委員会から承認を得た。われわれは、2000年1月から2020年8月までの入院患者の医療記録を遡及的にスクリーニングし、患者が不安や神経因性疼痛のためにガバペンチンを投与されている一方で、ベンゾジアゼピン離脱のために(テーパリングするための)ベンゾジアゼピン投与がされているケースをピックアップしていった。ベンゾジアゼピン離脱は、実際にベンゾジアゼピン離脱症状が発症していることで明らかである患者と、臨床医がベンゾジアゼピンの漸減治療をしていて、ベンゾジアゼピン身体依存症との診断を受けていた患者が対象被験患者に選定された。18歳未満の患者はスクリーニングから除外された。このスクリーニングによって、57 人の患者がベンゾジアゼピン離脱症状を呈しており、かつガバペンチンを投与されていることがわかった。これらの患者は、ベンゾジアゼピン離脱治療以外の理由でガバペンチンが同時に投与されており、主に不安や神経因性疼痛の対処が目的であった。一方で115人の患者がベンゾジアゼピン離脱中であり、ガバペンチンを服用していなかった。この群を本研究では「対照群」と呼ぶことにする(※訳注:ガバペンチン服用群は「治療群」)。
対照群はテーパリング用のベンゾジアゼピン以外には離脱症状緩和策となる他剤を一切服用していなかった。対照群および治療群ともに無作為抽出されたグループではない。患者の LOS、投与されたベンゾジアゼピンの総量、およびベンゾジアゼピンが投与された回数が主要評価項目として分析された。その他の属性については、性別、年齢、人種、精神障害の種類 (精神障害の診断と統計マニュアル第 4 版 (DSM-IV) の気分障害、統合失調症、またはその他の I 軸障害)、入院状況 (自発的か非自発的か)、そしてガバペンチン投与量が分析属性に含まれた。治療群と比較した対照群で不安、発作、神経因性疼痛を有する患者、またはこれら併存疾患を有さない患者の割合も分析され、これらの要因が上記の分析変数とともにガバペンチン投与と相関するかどうかを判断した。「その他」に当てはまる精神医学的診断項目には、ベンゾジアゼピン以外の物質使用障害、および気分障害と統合失調症以外の診断が含まれている。それぞれの診断は、入院時診断と退院時診断、および付随的な問題として記述されたカルテのメモを元に行われた。各患者の入院中に使用された向精神薬の種類が多岐にわたることを考慮し、患者の退院時に使用していた薬剤は気分安定剤、抗精神病薬、抗うつ薬に分類され、補足表 1 に示した。(補足デジタル コンテンツ 1 ー https://links.lww.com/JPP/A51)。患者が複数回入院した場合は、それぞれの入院を1件として評価に含めた。
統計分析
データは、ハリス郡精神医学センターの電子カルテデータベースからチャートのレビューを使用した。R21)、およびそのパッケージ ggplot222) pscl23) boot24) mfx25) countreg26) Sandwich27)28) lmtest29) および MASS30) が統計分析に使用された。(※ 訳注:統計プログラム言語である"R"が使用され、ロジスティック回帰分析の統計手法やブートストラップ法、グラフ可視化ツールのためのR言語のライブラリ群が使用された、という意味。)主な依存(転帰)尺度(dependent (outcome) measures)は、LOS(入院期間)と入院中に投与されたベンゾジアゼピンの総投与量 (BZ_AMT) で、ロラゼパム換算値で計算された 31)。主な独立(予測)変数(independent (predictor) variables)は、グループ(ガバペンチンあり vs ガバペンチンなし)、性別、人種、原発性第 I 軸障害(気分障害、統合失調症スペクトラム、その他)、入院状況(自発的か非自発的)、および年齢で、それらは潜在的な交絡をコントロールするために統計モデルの予測子として使用した。表 1 は、各グループの予測変数の概要を示している。対照群と比較して治療群における不安、発作、神経障害性疼痛の有無、またはこれらの併発症状の有無を評価するために反復測定分散分析を行った。
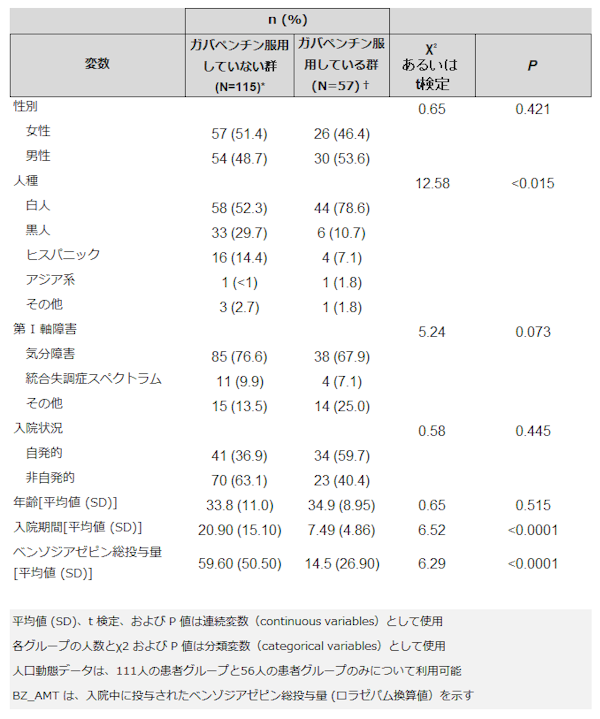
表1 - 各患者グループの人口動態と転帰変数
データ分析計画
結果変数 (LOS、BZ_AMT) の初期分析により、非正規分布が明らかになった。 LOS(入院期間)の場合、おおまかにポアソン分布または負の二項分布として近似的に分布した。BZ_AMT(ベンゾジアゼピン総投与量)では、ポアソン分布または負の二項分布として近似的に分布したが、ゼロ過剰(zero-inflated)でもあった (つまり、一部の離脱中患者はベンゾジアゼピンの投与が必要なかった)。一部の離脱中患者でベンゾジアゼピンが必要なかった理由は、離脱症状がほぼ不安症状に限定され、かつその症状が軽度であったからである。分布に基づいて、LOS の一次統計モデルでまずポアソン回帰と負の二項回帰の両方が検査された。赤池情報量基準 (AIC) 値とVoung検定の両方に基づき、一時結果では、負の二項モデルの方がよりうまく適合すると報告された。BZ_AMT変数がゼロ過剰(zero-inflated)であったため、現在の推奨事項 32),33) に従い、この変数の結果を分析するためにハードルモデルが使用された。モデル全体の適合性が標準的回帰モデル (非ハードルモデル) よりも優れていたためである。ハードル モデルとは、二つのパートを使用してモデル化された転帰変数をテストする2コンポーネント統計モデル( 2-component statistical model)である。二つのパートとは、まず最初のパートは、二項分布 (例:0 値となる確率と0より大きい値となる確率)であり、二つ目のパートは0以外の値をとる確率であり、それらをモデル化するのである。ハードル モデルを使用すると、標準的な統計モデルでは十分に説明できない、データ内のゼロ過剰 (ゼロインフレ) に対応できる。
したがって、ハードルモデルでは、結果は2 段階で考察される; → (1) 特定の予測因子は、かつて起きたイベント (例:患者がベンゾジアゼピンを投与されたかどうか) に影響を与えるかどうか;(2) 結果が少なくとも 1 回発生することを条件とした場合、特定の予測因子がそのイベントの発生回数/量 (例:ベンゾジアゼピン摂取量) に影響を与えるかどうか、の2段階である。ゼロ以外の値成分については、ポアソンモデルと負の二項モデルの両方がテストされ(AIC 値と Voung検定により)、LOS の場合と同様に、負の二項モデルがよりよく適合するモデルであることが示された。両方の結果尺度については、不均一分散の検定を用いて検査され、てこ比についてはクックの距離検定を活用した。どちらのモデルにも不均一分散性 (all Ps > 0.20) もなければ、てこ比 (no Di > 1) のエビデンスもなかった。非正規分布とモデルフィッティングアプローチを考慮すると、標準誤差は健全な範囲であり (単回帰。対照群の95%が信頼区間にある) 、十分に慎重であると報告されている。
RESULTS
表 1 は、2 つの患者グループのそれぞれの人口動態データと、グループ間の差異に対する χ2 または t 検定、および 2 つの結果尺度である LOS(入院期間)および BZ_AMT (入院期間中に投与されたベンゾジアゼピンの総投与量。ロラゼパム換算値で単位はmg)である。それぞれのグループは、年齢 (t166=0.65、P=0.515)。 性別 (χ22=0.65、P=0.421); I 軸障害 (χ22=5.24、P=0.073)。 そして入院ステータス (自発的か非自発的か。χ22=0.58、P=0.445)による統計的差異はなかった。しかし人種構成については統計的差異が認められ (χ24=12.58、P<0.015)、非ガバペンチングループには黒人およびヒスパニック系の患者が比例的多く含まれていた。ガバペンチン群の患者で投与されたガバペンチンの平均用量は107~888 mgの範囲であった。ただ1名だけ平均用量3000mgの高用量者がいた。1 回あたり300mg服用患者がもっとも多かった。ガバペンチンが投与された回数および各患者に投与されたガバペンチンの総量を含むさらなる情報は、補足2に示す → (補足2表 https://links.lww.com/JPP/A52 )
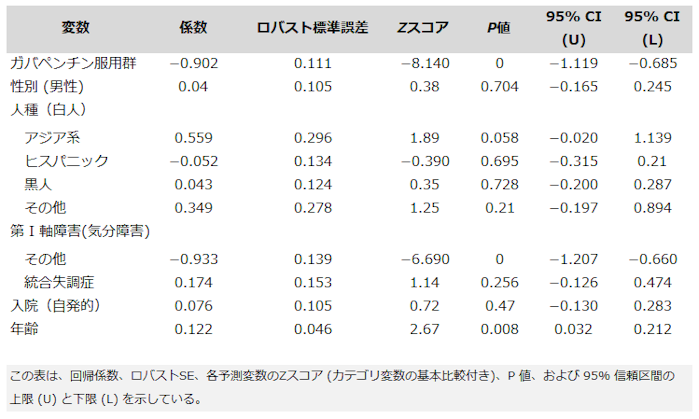
表2は、予測因子グループ、年齢、性別、人種、第 1 軸障害、とともに結果変数である入院ステータスの負の二項回帰の結果を示している。全体的な回帰モデルはχ210=177.53、P<0.0001、対数尤度=-564.07、AIC=1152.14を示した。ガバペンチン群の LOS は有意に短かった (Z=-8.14、P<0.0001)。「年齢」および「その他疾病」カテゴリーを除いて、他の予測変数はどれも有意なものはなかった。
表 2 - 入院期間結果変数に関する負の二項回帰モデルの結果
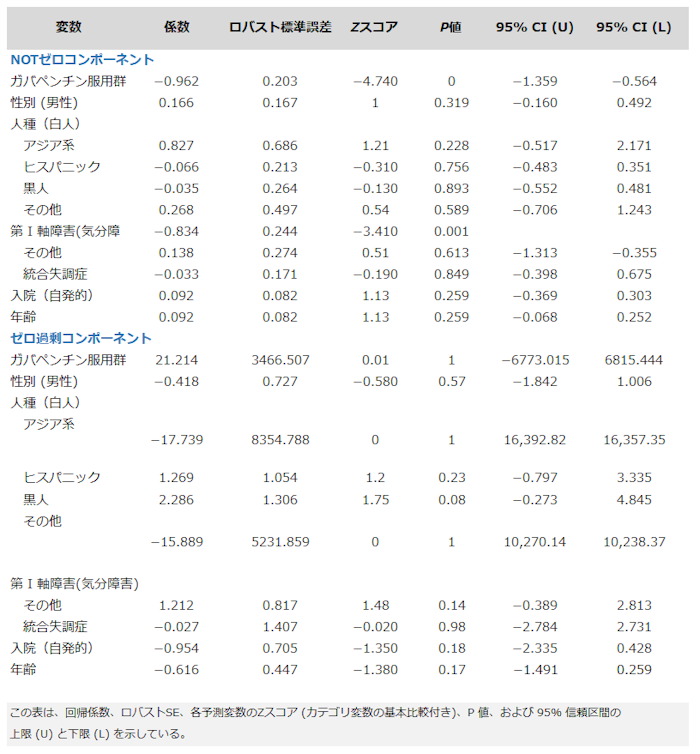
表3は、非ゼロデータに対する負の二項回帰を使用したBZ_AMT(ベンゾジアゼピン総投与量)のハードルモデルの結果を示している。モデルは全体的に、対数尤度 -734.85、AIC=1515.71 を示した。モデルの非ゼロ患者(※訳注:ベンゾジアゼピンを使用してテーパリングした患者)について、ガバペンチン服用グループは有意にベンゾジアゼピン摂取量が少なかった(ロラゼパム換算、Z=-4.74、P<0.0001)。
軸 I カテゴリー「その他の疾患」は、気分障害よりも有意にベンゾジアゼピン摂取量が少なかった (Z=-3.41、P<0.001)。他の予測変数はいずれも、非ゼロ患者に対して有意ではなかった。ゼロカウント患者 (0 対 >0 ベンゾジアゼピンが必要なかった患者) では、グループ(ガパペンチン有 vs 無)や、他の予測変数による有意差はなかった。補足図 1 ~ 3 (補足図 ③、https://links.lww.com/JPP/A53) は、 結果変数LOSやBZ_AMTに関する、箱ひげ図とヒストグラムによる詳細な視覚情報を示している。併存疾患(不安、発作、神経因性疼痛)があるか、または無いかのノンパラメトリック分散分析では、治療群(ガパペンチン有)と対照群(ガパペンチン無)の間に有意差は示されなかった(df=3、P=0.112)(補足表④、https://links.lww.com/JPP/A54)。
表 3 - 結果変数BZ_AMT (ベンゾジアゼピン投与総量) について、非ゼロ患者とゼロ (対ゼロ) 患者を負の二項回帰したハードル モデルの結果
DISCUSSION
本研究で、電子カルテデータの遡及的分析によって、ベンゾジアゼピン使用の補助としてガバペンチンの投与をされていたベンゾジアゼピン離脱患者は、ガバペンチンの投与をされていなかった対照群と比較して、ベンゾジアゼピンの総投与量が少なく、入院期間も短いものであったことが明らかになった。ベンゾジアゼピン離脱にあたって、ベンゾジアゼピンそのものの「テーパリング(漸減)」以外に離脱治療法がなかったことを考えると34)、乱用、薬物相互作用による合併症、過剰鎮静などの副作用など潜在的なリスクを軽減できるため、ベンゾジアゼピン離脱に直截的な補助となる代替薬を見いだすことは非常に重要である。睡眠や記憶の問題など、ベンゾジアゼピンの使用に関連する長期的な問題もある。本研究結果は、ガバペンチンがベンゾジアゼピン離脱治療において、補助薬として使用できる予備的なエビデンスになり得るだろう。
軸 I カテゴリー「その他の疾患」を持つ患者は、気分障害患者よりも有意に少ない量のベンゾジアゼピンで済んでいた。気分障害または統合失調症スペクトラムの障害以外の疾患が「その他の疾患」に含まれる。「その他の疾患」の診断カテゴリーには、一次診断のほとんどに薬物乱用が含まれていた。薬物乱用により精神病院に入院した患者は一般的に、薬物が代謝され精神症状が解消した後、わりとすぐに退院することを考慮すると(本研究で得たデータの提供元がまさにそういった薬物乱用患者を受け入れる精神病院なのであるが)、「その他の疾患」カテゴリーが、気分障害や統合失調症スペクトラムの障害と比較して、より短いLOS(入院期間)と少量のBZ_AMT(ベンゾジアゼピン総投与量)で済んでいることは驚くに値しない。不安症状に対して主に投与されてきたベンゾジアゼピンであるが、ガバペンチンもまた不安を軽減することが知られており 19,35)、これもLOS の短縮とBZ-AMTの減少に寄与している可能性がある。年齢、性別、人種、入院ステータス(自発的か非自発的か)、統合失調症などの予測変数は、LOS およびBZ_AMTに有意な共分散を示さなかった。さらに、不安、発作、神経障害性疼痛を患う患者グループと、これらの症状を持たない患者グループを調査したところ、それら疾患の有無が、対照群と治療群から得られた結果に対して統計的に影響を及ぼさないことが明らかになった。つまり、こうした疾患の併存とは無関係に、ガバペンチン使用が(ベンゾジアゼピン離脱中における)ベンゾジアゼピン総投与量の減少に寄与している可能性が高いといえる。
以前の研究では、ガバペンチンを 1 日の総用量600 ~ 1800 mgで使用すると、アルコール離脱症状が軽減されることが示されている17,36,37)。我々の研究では、患者カルテの分析データに予期せぬ合併症や、薬剤関連副作用が観察されなかったため、ガバペンチンとベンゾジアゼピンの併用は安全であると考えられる。ガバペンチン服用群ではベンゾジアゼピン総投与量が少なかったという結果から、ガバペンチンはベンゾジアゼピン離脱の治療に有益である可能性は十分ある。ただし、以下で説明するいくつかの制限により、この仮説はあくまで予備調査的なものとして考慮する必要がある。
注目すべきは、メサドン維持療法を受けているベンゾジアゼピン乱用あるいは身体依存症の治療のためのガバペンチンの使用を検討したパイロット研究である38)。その臨床試験では、ベンゾジアゼピン総投与量の中央値はガバペンチン群とプラセボ群の両方で減少し、おそらくサンプルサイズがとても小さかったためだと思うが、プラセボ群とガバペンチン服用群の間に有意差は見いだせなかった。(ガバペンチン服用群6名、プラセボ群10名によるランダム化比較試験)。このパイロット研究では、ガバペンチン服用群の平均用量は 2666mg ±1446 mg/日となっている。サンプルサイズが非常に小さいため、ベンゾジアゼピン離脱治療におけるガバペンチンの最適用量を決定するには、ランダム化比較対照臨床試験を含む、さらなる質の高い研究が必要だ。
ベンゾジアゼピン離脱治療への薬理学的アプローチが現在検討されているが、いっぽうで心理社会的介入もベンゾジアゼピン依存症の治療に使用されていることには留意すべきである39)。ベンゾジアゼピン離脱症状を軽減するために、動機づけ面接(MI)、認知行動療法(CBT)42-45)、リラクゼーションやその他のいくつかのスキルトレーニング46-48)、および実践者からのリマインダーレター49,50)が検討されている研究がいくつかある。ベンゾジアゼピン身体依存症に対する CBTとMI のメタ分析では、CBTは3 か月間であれば有効であるが、その効果は 6 か月間を超えて持続できないことが実証された39)。この研究では39)、動機づけ面接(MI)の有効性についてエビデンスが不十分であることも示している。リラクゼーションにや実践者からのリマインダーレター(手紙)関しては、予備的エビデンスは、ベンゾジアゼピン離脱管理に効果的である可能性をいちおう示している。ベンゾジアゼピン離脱に対処するための薬理学的介入と心理社会的介入の双方に関する利用可能な研究がまだ他にもあるかもしれない。
本研究には、導かれた結論があくまで暫定的なものに過ぎないとする、いくつかの制限があった。もっとも大きな制限は、本研究のサンプルサイズが比較的小さい後ろ向き研究(retrospective study)であることだ。この欠点により、投与されたベンゾジアゼピンの種類、投与されたガバペンチンの量、およびグループ全体にわたる第 I 軸障害の種類と比率の標準化が妨げられている。これにより、ガバペンチンの補助的使用が、ある診断グループ (つまり、気分障害と統合失調症スペクトラム) への効果が、別の診断グループへの効果を上回ったのかどうかが不明瞭となっている。また、ベンゾジアゼピン離脱症状が記録されている患者群の中にガバペンチンを服用している患者数が限られていたことも本研究の制限のひとつだ。さらに、ベンゾジアゼピン総投与量を標準化するために BZ_AMT の測定基準をロラゼパム換算値に変換したが、実際に処方されていたベンゾジアゼピンの種類はばらつきがあった。ベンゾジアゼピンの種類によって半減期が違うため代謝が異なる51)。これにより、結果に未知の変動要因が生じた可能性がある。また、データセットには、ベンゾジアゼピン投与時の発汗、血圧の変化、頻脈などの離脱症状の客観的マーカーも欠如していた。電子カルテデータにおける離脱症状の記録に一貫性がないためである。臨床研究所離脱評価尺度 - ベンゾジアエピン (CIWA-B) などのような、離脱の客観的なマーカー、標準化された離脱尺度を使用していれば、症状とその重症度に関するより具体的な尺度が得られ、ベンゾジアゼピン離脱におけるガバペンチンの効果を評価するのに役立ったであろう。本研究におけるさらなる制限は、独立した臨床医が各患者を評価検証する代わりに電子カルテデータを使用することにも起因している。電子カルテデータに頼った分析は、人口統計データの一部欠落、離脱の重症度の検証不能、入手可能なデータからの選択バイアスにもつながった。データは米国南部の精神科入院病院から得られたものであり、ベンゾジアゼピン依存症と離脱症状の治療アプローチには地域差や、専門分野間の違いがあることを認識することも重要である。したがって、本研究の調査結果は、米国南部の精神科入院施設の患者群172名だけで得られたものであると言わざるを得ない。ベンゾジアゼピン離脱治療に必要かつ役立つ補助薬としてガバペンチンをより正確に評価するには、外来患者と入院患者の両方でいくつかの地域にわたるランダム化比較対照臨床試験が必要となるだろう。しかし、これまでに述べた制限はあるものの、現在の限られた選択肢を考慮すると、本研究はベンゾジアゼピン離脱患者を助ける補助治療法としてのガバペンチンの可能性に光明を見出したといえる。
ACKNOWLEDGMENTS
本研究のために患者データ収集を手伝ってくれたGregory Cervenkaに感謝の意を表す。
REFERENCES
1. Hood SD, Norman A, Hince DA, et al. Benzodiazepine dependence and its treatment with low dose flumazenil. Br J Clin Pharmacol. 2014;77:285–294.
2. Pétursson H, Lader MH. Withdrawal from long-term benzodiazepine treatment. Br Med J. 1981;283:643–645.
3. De Cuevas C Las, Sanz EJ, De La Fuente JA, et al. The Severity of Dependence Scale (SDS) as screening test for benzodiazepine dependence: SDS validation study. Addiction. 2000;95:245–250.
4. Ashton H. Protracted withdrawal syndromes from benzodiazepines. J Subst Abuse Treat. 1991;8:19–28.
5. NIDA Notes Staff. Well-known Mechanism Underlies Benzodiazepines’ Addictive Properties. Bethesda, MD: National Institute of Drug Abuse, NIDA Notes; 2012. Available at: https://archives.drugabuse.gov/news-events/nida-notes/2012/04/well-known-mechanism-underlies-benzodiazepines-addictive-properties. Accessed April 5, 2022.
6. Pétursson H. The benzodiazepine withdrawal syndrome. Addiction. 1994;89:1455–1459.
7. Soyka M. Treatment of benzodiazepine dependence. N Engl J Med. 2017;376:1147–1157.
8. O’brien CP. Benzodiazepine use, abuse, and dependence. J Clin Psychiatry. 2005;66(suppl 20):28–33.
9. Penninga EI, Graudal N, Ladekarl MB, et al. Adverse events associated with flumazenil treatment for the management of suspected benzodiazepine intoxication—a systematic review with meta-analyses of randomised trials. Basic Clin Pharmacol Toxicol. 2016;118:37–44.
10. Saguil A, Kane S, Mercado M, et al. Herpes zoster and postherpetic neuralgia: prevention and management. Am Fam Physician. 2017;96:656–663.
11. Bockbrader HN, Wesche D, Miller R, et al. A comparison of the pharmacokinetics and pharmacodynamics of pregabalin and gabapentin. Clin Pharmacokinet. 2010;49:661–669.
12. Wiffen PJ, Derry S, Bell RF, et al. Gabapentin for chronic neuropathic pain in adults. Cochrane Database Syst Rev. 2017;6:CD007938.
13. Altamura AC, Moliterno D, Paletta S, et al. Understanding the pharmacokinetics of anxiolytic drugs. Expert Opin Drug Metab Toxicol. 2013;9:423–440.
14. Quintero GC. Review about gabapentin misuse, interactions, contraindications and side effects. J Exp Pharmacol. 2017;9:13–21.
15. Campbell LS, Coomer TN, Jacob GK, et al. Gabapentin controlled substance status. J Am Pharm Assoc. 2021;61:e218–e224.
16. Hayashida KI, Eisenach JC. Descending noradrenergic inhibition: an important mechanism of gabapentin analgesia in neuropathic pain. Adv Exp Med Biol. 2018;1099:93–100.
17. Myrick H, Malcolm R, Randall PK, et al. A double-blind trial of gabapentin versus lorazepam in the treatment of alcohol withdrawal. Alcohol Clin Exp Res. 2009;33:1582–1588.
18. Muncie HL Jr, Yasinian Y, Oge’ L. Outpatient management of alcohol withdrawal syndrome. Am Fam Physician. 2013;88:589–595.
19. Berlin RK, Butler PM, Perloff MD. Gabapentin therapy in psychiatric disorders: a systematic review. Prim Care Companion CNS Disord. 2015:17. doi:10.4088/PCC.15r01821.
20. Lejoyeux M, Solomon J, Adès J. Benzodiazepine treatment for alcohol-dependent patients. Alcohol Alcohol. 1998;33:563–575.
21. R Development Core Team. R: a language and environment for statistical computing. The R Project for Statistical Computing. 2013. Available at: https://www.r-project.org. Accessed June 18, 2021.
22. Wilkinson L. ggplot2: elegant graphics for data analysis by WICKHAM, H. Biometrics. 2011;67:678–679. doi:10.1111/J.1541-0420.2011.01616.X.
23. Jackman S, Tahk A, Zeileis A, et al. Package “pscl”. Political Science Computational Laboratory. Published online March 7, 2020. Available at: https://cran.r-project.org/web/packages/pscl/pscl.pdf. Accessed June 18, 2021.
24. Package “boot.” Published online May 3, 2021. Available at: https://cran.r-project.org/web/packages/boot/index.html. Accessed June 18, 2021.
25. Package “mfx”. Marginal effects, odds ratios and incidence rate ratios for GLMs. Published online February 6, 2019. Available at: https://cran.r-project.org/web/packages/mfx/mfx.pdf. Accessed June 18, 2021.
26. Zeileis A, Kleiber C, Jackman S. Regression models for count data in R. 2008. Available at: https://cran.r-project.org/web/packages/pscl/vignettes/countreg.pdf. Accessed July 7, 2021.
27. Zeileis A, Lumley T, Graham N, et al. Robust covariance matrix estimators. Published online May 18, 2021. Available at: CRAN—Package sandwich (r-project.org). Accessed July 7, 2021.
28. Zeileis A, Köll S, Graham N. Various versatile variances: an object-oriented implementation of clustered covariances in R. J Stat Softw. 2020;95:1–36. doi:10.18637/JSS.V095.I01.
29. Title Testing Linear Regression Models. Initially published online 2020. Most recent version. Published March 22, 2022. Available at: https://cran.r-project.org/web/packages/lmtest/lmtest.pdf. Accessed July 7, 2021.
30. Ripley B, Venables W, Bates DM, et al. Package “MASS.” Initially published online 2021. Most recent version published March 23, 2022. Available at: https://cran.r-project.org/web/packages/MASS/index.html. Accessed July 7, 2021.
31. Ashton CH. Benzodiazepine equivalence table. Part of the Ashton Manual Webpage: Benzodiazepines: How They Work and How to Withdraw. Available at: https://www.benzo.org.uk/bzequiv.htm. Accessed July 29, 2021.
32. Cameron AC, Trivedi PK. Regression Analysis of Count Data, Second Edition. Cambridge, UK: Cambridge University Press; 2013.
33. Hu MC, Pavlicova M, Nunes EV. Zero-inflated and hurdle models of count data with extra zeros: examples from an HIV-risk reduction intervention trial. Am J Drug Alcohol Abuse. 2011;37:367–375.
34. Brett J, Murnion B. Management of benzodiazepine misuse and dependence. Aust Prescr. 2015;38:152–155.
35. Greenblatt HK, Greenblatt DJ. Gabapentin and pregabalin for the treatment of anxiety disorders. Clin Pharmacol Drug Dev. 2018;7:228–232.
36. Mason BJ, Quello S, Shadan F. Gabapentin for the treatment of alcohol use disorder. Expert Opin Investig Drugs. 2018;27:113–124.
37. Mason BJ, Quello S, Goodell V, et al. Gabapentin treatment for alcohol dependence: a randomized controlled trial. JAMA Intern Med. 2014;174:70–77.
38. Mariani JJ, Malcolm RJ, Mamczur AK, et al. Pilot trial of gabapentin for the treatment of benzodiazepine abuse or dependence in methadone maintenance patients. Am J Drug Alcohol Abuse. 2016;42:333–340. Erratum in: Am J Drug Alcohol Abuse. 2021;47:521.
39. Darker CD, Sweeney BP, Barry JM, et al. Psychosocial interventions for benzodiazepine harmful use, abuse or dependence. Cochrane Database Syst Rev. 2015;5:CD009652.
40. Bagøien G, Bjørngaard J, Østensen C, et al. The effects of motivational interviewing on patients with comorbid substance use admitted to a psychiatric emergency unit—a randomised controlled trial with two year follow‐up. BMC Psychiatry. 2013;13:93.
41. Carroll KM, Ball SA, Nich C, et al. Motivational interviewing to improve treatment engagement and outcome in individuals seeking treatment for substance abuse: a multisite effectiveness study. Drug Alcohol Depend. 2006;81:301–312.
42. Becka J. Efficacy of cognitive behavioral methods in decreasing drug use by methadone clinic patients compared with standard conditions. Cesk Psychiatr. 2004;100(suppl 1):4–7.
43. Baillargeon L, Landreville P, Verreault R, et al. Discontinuation of benzodiazepines among older insomniac adults treated with cognitive‐behavioural therapy combined with gradual tapering: a randomized trial. Can Med Assoc J. 2003;169:1015–1020.
44. Belleville G, Guay C, Guay B, et al. Hypnotic taper with or without self‐help treatment of insomnia: a randomized clinical trial. J Consult Clin Psychol. 2007;75:325–335.
45. Gosselin P, Ladouceur R, Morin CM, et al. Benzodiazepine discontinuation among adults with GAD: a randomized trial of cognitive‐behavioral therapy. J Consult Clin Psychol. 2006;74:908–919.
46. Elliott L, Glenday J, Freeman L, et al. Reducing diazepam prescribing for illicit drug users: a randomised control study. Drug Alcohol Rev. 2005;24:25–31.
47. Elsesser K, Sartory G, Maurer J. The efficacy of complaints management training in facilitating benzodiazepine withdrawal. Behav Res Ther. 1996;34:149–156.
48. Gilbert A, Owen N, Innes JM, et al. Trial of an intervention to reduce chronic benzodiazepine use among residents of aged‐care accommodation. Aust N Z J Med. 1993;23:343–347.
49. Heather N, Bowie A, Ashton H, et al. Randomised controlled trial of two brief interventions against long‐term benzodiazepine use: outcome of intervention. Addict Res Theory. 2004;12:141–154.
50. Ten Wolde GB, Dijkstra A, van Empelen P, et al. Long‐term effectiveness of computer‐generated tailored patient education on benzodiazepines: a randomized controlled trial. Addiction. 2008;103:662–670.
51. Griffin CE III, Kaye AM, Bueno FR, et al. Benzodiazepine pharmacology and central nervous system-mediated effects. Ochsner J. 2013;13:214–223.
52. Busto UE, Sykora K, Sellers EM. A clinical scale to assess benzodiazepine withdrawal. J Clin Psychopharmacol. 1989;9:412–416.
(翻訳、訳注:ベンゾジアゼピン情報センター 管理人)
著者:Edison Leung, MD, PhD エディソン・レオン、医師・医学博士

アルバート アインシュタイン医科大学で、分子癌生物学を主に研究対象とし博士号を取得。 現在携わっている研究は、アルコールあるいはオピオイドを単一使用した場合と比較して、両剤を併用した際の物質使用障害がシグナル伝達経路に与える変化・影響について研究中。
テキサス大学医療科学センターatヒューストンの「精神科学調査プログラム」を選んだ理由:
プログラムで利用できる膨大な最先端の研究の機会、環境、メンターシップが、このプログラムには十分ありました。 ここに 3 年間滞在して、これらのニーズだけでなくそれ以上の成果も得ることができました。 今年4 年目は、研究とともに教員としてのキャリアにも注力するつもりです。